Hai bisogno di aiuto per scegliere il prodotto giusto?
Il nostro strumento ti aiuterà a trovare il prodotto più adatto alle tue esigenze
Accedi allo strumento di selezione dei prodottiBenvenuto sul sito Italiano
Abbiamo rilevato che potresti preferire il sito Global. Se necessario, utilizza il menu a tendina delle lingue per modificare la scelta.
La liofilizzazione (nota anche come crioessiccamento) è un processo batch lento, utilizzato nelle industrie farmaceutiche e biotecnologiche (come la produzione alimentare) per estrarre prodotto secco da una soluzione acquosa. Il materiale in polvere risultante può essere facilmente immagazzinato, spedito e successivamente ricostituito per l’uso in prodotti quali compresse solide e soluzioni solubili. La liofilizzazione si effettua congelando il materiale, quindi riducendo la pressione e aggiungendo calore per consentire all’acqua congelata nel materiale di sublimare in corrispondenza del punto triplo dell’acqua.
A titolo di esempio: i medicinali iniettabili sono generalmente collocati in fiale di vetro poste sui ripiani di una camera in vuoto, che viene prima portata alla temperatura di congelamento e poi evacuata per creare il vuoto. I ripiani quindi, vengono riscaldati molto lentamente per sublimare il liquido, mentre la camera viene continuamente evacuata attraverso un condensatore a freddo. Superati gli zero gradi, la valvola di isolamento della camera viene chiusa e viene eseguito un “test di aumento della pressione” per assicurare che siano state soddisfatte le condizioni di essiccazione appropriate.
Poiché la crioessiccazione è un processo energivoro, è importante sviluppare cicli di asciugatura economici adatti alla produzione su larga scala. Inoltre, se non vengono utilizzate in modo efficace, le unità a vuoto e di refrigerazione richiedono una manutenzione regolare e approfondita. Per gestire l’essiccazione quindi, è necessario un sistema di controllo efficiente dell’automazione del processo.
Esistono diverse impostazioni per i liofilizzatori, gli elementi essenziali sono:
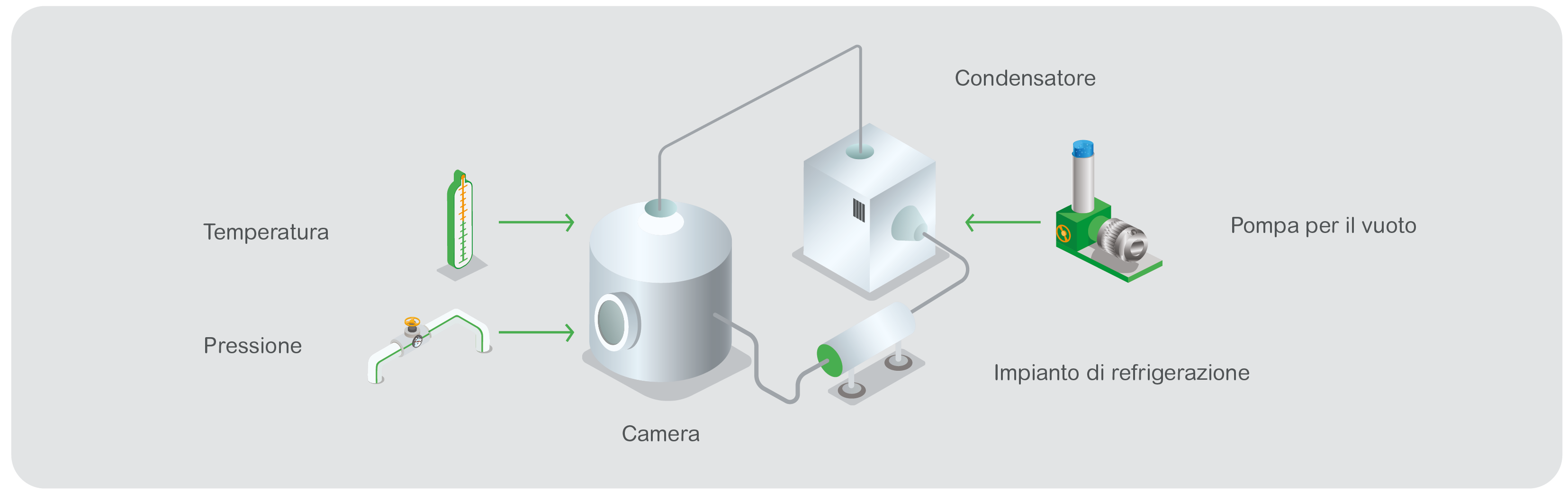
La temperatura può essere controllata elettricamente tramite tappetini riscaldanti sui ripiani o facendo circolare olio attraverso tubi saldati ai ripiani nella camera. La temperatura della camera, dei ripiani (e/o dell’olio di riscaldamento) e il condensatore, fanno parte delle variabili di controllo e monitoraggio, note anche come parametri critici di processo (CPP). In genere esistono sensori separati per la sterilizzazione, che richiedono anche il monitoraggio.
La pressione in vuoto può essere misurata con un manometro pirani. Il controllo viene effettuato tramite una valvola analogica ad ago o valvole di aerazione più o meno accurate. Per commutare l’impianto di refrigerazione dal congelamento della camera al congelamento del condensatore, si utilizza una valvola di commutazione. Nella fase di asciugatura finale, la depressione può essere ridotta il più possibile per favorire il desorbimento del materiale, oppure può essere controllata per proteggere il prodotto da un’eccessiva disidratazione.
Generalmente la fasi della liofilizzazione sono quattro:
Il processo completo è caratterizzato da lunghi periodi di stabilizzazione. Ad esempio, nella fase di congelamento, la temperatura del ripiano viene portata tra -50°C (-58°F) e -80°C (-112°F), in genere in più fasi (talvolta in profili più complessi di una rampa semplice), convertendo la maggior parte dell’acqua in ghiaccio.
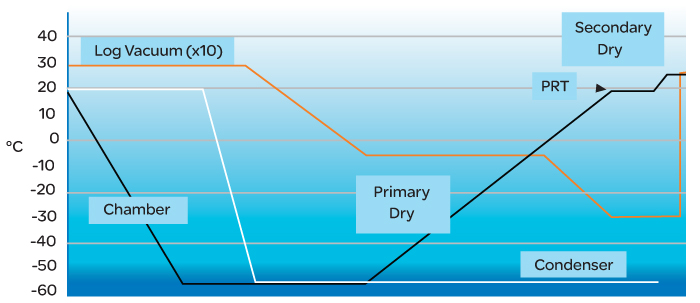
La fase critica e più lunga è quella di essiccazione primaria, in cui la velocità alla quale l’acqua sublima deve essere sufficientemente lenta da non danneggiare il prodotto. Durante questa fase, il vuoto viene mantenuto costante per garantire condizioni stabili. La rampa di temperatura deve essere tenuta in caso di aumento eccessivo del vuoto, indica infatti che il prodotto sta sublimando troppo rapidamente.
Al termine della rampa di essiccazione primaria, viene eseguito un test di aumento della pressione (PRT – Pressure Rise Test). Una volta che il prodotto è stato riscaldato, tutta l’acqua dovrebbe essere stata espulsa. La temperatura effettiva dipende dal prodotto, ma sarà superiore a quella ambiente. Per controllare l’essiccazione viene eseguito un PRT (in genere automatizzato). Si controlla che non ci sia più evaporazione sigillando la camera e individuando eventuali aumenti di pressione.
Successivamente al PRT si procede con la fase di essiccazione secondaria per ridurre il più possibile l’umidità residua. Il prodotto raggiunge o supera la temperatura ambiente. Generalmente, al termine del processo, è necessario sterilizzare la macchina. Ciò si ottiene con una strategia alternativa nel sistema di controllo che utilizza vapore o gas (come ossido di etilene – ETO, EtO, EO).
Le nostre soluzioni soddisfano i requisiti di registrazione elettronica e firma elettronica definiti dagli enti normativi statunitensi e dell’UE.
Per prendere decisioni valide, è necessario poter considerare attendibili i dati. I principali organismi di regolamentazione (FDA, EMA, OMS) e alcuni organismi consultivi (PIC/S, ISPE) hanno concordato circa il concetto ALCOA+ relativo all’integrità dei dati. ALCOA+ definisce che i dati devono essere Attribuibili, Leggibili, Contemporanei, Originali e Accurati + Completi, Coerenti, Duraturi e Disponibili. In qualità di fornitore di soluzioni, affermato nei processi delle scienze della vita, Eurotherm è uno dei principali sostenitori di questa visione e ha contribuito alla definizione e alla revisione di alcune di queste linee guida.
Gli investimenti aziendali devono essere adatti alle sfide del futuro e gli audit non devono comportare problemi.
Eurotherm ha sviluppato e ampiamente applicato una serie di documenti di qualifica delle buone prassi ingegneristiche (GEP) basati sulle linee guida ISPE GAMP 5 per contribuire al raggiungimento di tali obiettivi. I documenti di qualifica possono essere conservati in formato elettronico. L’industria sta passando dalla produzione basata su procedure operative standard (SOP) manuali a un approccio digitalizzato basato su sistemi di qualità privi di carta e basato sulle linee guida FDA e ICH.
In un approccio basato sulla qualità in fase di progettazione (QbD), la qualità del prodotto viene costantemente monitorata e controllata nelle prime fasi, invece di attendere il termine di un processo. I produttori farmaceutici devono concentrarsi sull’identificazione, il controllo e la convalida delle variabili di processo che potrebbero determinare un risultato non conforme. A tale scopo, è necessario gestire il profilo QTPP (Quality Target Product Profile), gli attributi di qualità critici (CQA) e i parametri di processo critici (CPP).
Come definito dall’approccio PAT (Process Analytics Technology), Eurotherm può fornire assistenza nella misurazione e nell’analisi delle prestazioni dei CQA e contribuire alla gestione delle deviazioni dei CPP, fornendo prove orodatate della correlazione dei comportamenti dei parametri al loro verificarsi.

Le soluzioni di controllo e registrazione dati di Eurotherm sono EcoStruxure-ready e forniscono un livello di integrità dei dati all’interno della piattaforma EcoStruxure™ di Schneider Electric. EcoStruxure è l’architettura di sistema aperta abilitata per l’IoT di Schneider che favorisce la trasformazione digitale in tecnologia Pharma 4.0.
Strumento di selezione dei prodotti
Il nostro strumento ti aiuterà a trovare il prodotto più adatto alle tue esigenze
Accedi allo strumento di selezione dei prodottiContattaci